
- Szerző Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Utoljára módosítva 2025-01-22 17:00.
A anyajegy egy kémiai számláló egység, úgy, hogy 1 anyajegy = 6,022*1023 részecske. A sztöchiometria is megköveteli a használatát kiegyensúlyozott egyenletek . Tól kiegyensúlyozott egyenlet megkaphatjuk a mólarány . Az mólarány az a hányados nak,-nek anyajegyek egy anyagból a anyajegyek egy másik anyag a kiegyensúlyozott egyenlet.
Csak így, hány mol van 1 kg NaCl-ben?
Az anyagmennyiség SI alapegysége a mól. 1 mol egyenlő 1 mol NaCl-val, vagy 58.44277 gramm.
Hasonlóképpen, hogyan határozható meg a sztöchiometrikus arány? Így kiszámításához a sztöchiometria tömegre vonatkoztatva, az egyes reagensekhez szükséges molekulák számát mólokban fejezzük ki, és megszorozzuk az egyes reagensek móltömegével, így megkapjuk az egyes reagensek tömegét a reakció móljára vonatkoztatva. A tömeg arányok úgy számítható ki, hogy mindegyiket elosztjuk a teljes reakcióban szereplő összeggel.
Tudja azt is, mi a mólarány?
az hányados az összegek között anyajegyek bármely két kémiai reakcióban részt vevő vegyület közül. Mólarányok A termékek és a reagensek közötti konverziós tényezőket számos kémiai problémában használják.
Miért fontos a mólarány?
1 Válasz. Mólarányok vannak fontos mivel mólarányok engedje meg a változtatást anyajegyek egy anyagról anyajegyek egy másik anyagból. Az mólarány a varázslat, amely A-ból B-be változik mólarányok a kémiai képletből vagy egyenletből származnak.
Ajánlott:
Hogyan határozza meg a folyamatos változás a mólarányt?

Ez a kísérlet a folyamatos variáció módszerét alkalmazza a két reaktáns mólarányának meghatározására. A folytonos változtatások módszerében a reaktánsok összes mólszámát egy méréssorozathoz állandó értéken tartják. Minden mérést a reaktánsok eltérő mólarányával vagy mólarányával végeznek
Hogyan találja meg a molekulák számát egy kémiai képletben?
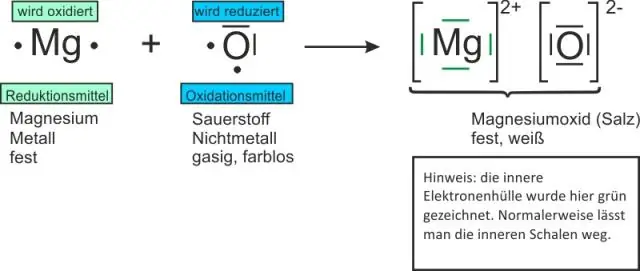
A mólok szorzása az Avogadro-állandóval A mintában lévő molekulák számának kiszámításához szorozza meg a mólok számát az Avogadro-állandóval, 6,022 x 10^23
Honnan lehet tudni, hogy egy kémiai egyenletben új anyag keletkezik?

Vannak arra utaló jelek, hogy kémiai reakció lép fel. Buborékok képződnek, gáz szabadul fel, és a főzőpohár nagyon felforrósodik. A kémiai reakció bekövetkezésének legfontosabb jele az új anyagok képződése. Az új anyagok a szén, a törékeny fekete szilárd anyag és a vízgőz, színtelen gáz
Mit mondanak el az együtthatók egy kiegyensúlyozott kémiai egyenletben a reaktánsokról és a termékekről?

A kiegyensúlyozott kémiai egyenlet együtthatói megmondják a reagensek és termékek relatív mólszámát. A sztöchiometrikus problémák megoldása során olyan konverziós tényezőket alkalmaznak, amelyek a reagensek móljainak és a termékmóljainak viszonyát képezik. A tömegszámításoknál a moláris tömegre van szükség a tömeg mólokra való átalakításához
Hogyan találja meg a korlátozás tartományát egy egyenletben?

Hogyan: Adott egyenlet alakban írt függvény, amely törtet tartalmaz, keresse meg a tartományt. Határozza meg a bemeneti értékeket. Határozza meg a bemenetre vonatkozó esetleges korlátozásokat. Ha van nevező a függvény képletében, állítsa a nevezőt nullára, és oldja meg x
