
- Szerző Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Utoljára módosítva 2025-01-22 17:00.
Az képződés entalpiája egy elem elemi állapotában mindig az lesz 0 mert nem igényel energiát a természetben előforduló vegyület előállításához. Amikor egy anyag az alakított annak legstabilabb formájából elemeket , változás a entalpia zajlik.
Hasonlóképpen feltehetjük a kérdést, hogy mely anyagok képződési entalpiája nulla?
Minden elem normál állapotában (oxigén gáz, szilárd szén formájában grafit stb.) normál képződési entalpiája nulla, mivel a kialakulásukban nincs változás.
Ezt követően a kérdés az, hogy mekkora a vízképződés entalpiája? Válogatott ATcT képződésentalpia a Thermochemical Network 1.118-as verziója alapján
| Faj neve | Képlet | ΔfH° (298,15 K) |
|---|---|---|
| Víz | H2O (kr, ekv.press.) | -292.740 |
Ennek megfelelően miért nem nulla a gyémánt standard képződési entalpiája, bár az elem?
Az standard képződésentalpia egy elem abban alapértelmezett állapot az NULLA !!!! Tehát ΔH°f C (s, grafit) esetén az nulla , de a ΔH°f C (s, gyémánt ) 2 kJ/mol. Ez azért van, mert a grafit az alapértelmezett szén állapot, nem gyémánt.
Mit jelent, ha a Delta h nulla?
Csak az entalpia változásait tudják mérni. Amikor az entalpia pozitív és delta H nagyobb, mint nulla , ezt eszközök hogy egy rendszer hőt nyel el. Ezt endoterm reakciónak nevezik. Amikor az entalpia negatív és delta H kevesebb mint nulla , ezt eszközök hogy egy rendszer hőt bocsátott ki. Ezt exoterm reakciónak nevezik.
Ajánlott:
Miért nulla az indukált emf, ha a mágneses fluxus maximális?

Amikor a tekercs függőlegesen áll, nem változik a mágneses fluxus (azaz emf=0), mivel a tekercs nem „vág át” az erővonalakon. Az indukált emf nulla, ha a tekercsek merőlegesek a mezővonalakra, és maximum, ha párhuzamosak. Ne feledje, hogy az indukált emf a mágneses fluxus kapcsolat változásának sebessége
Miért nulla az EMF, amikor a tekercs pontosan a mágnes közepén halad át?
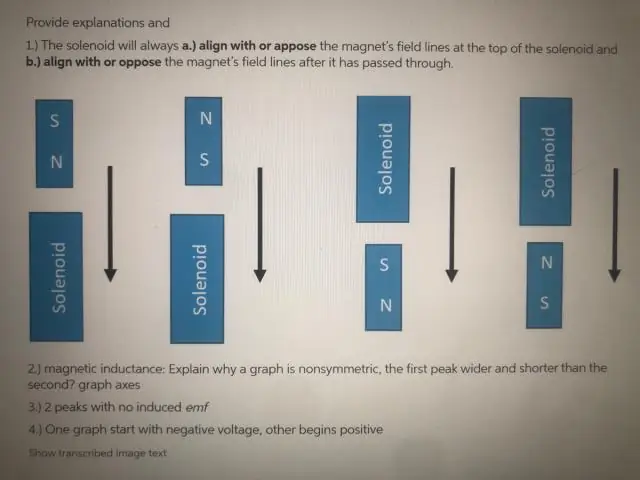
Az emf csak egy pillanatra nulla, amikor a mágnes áthalad a tekercs pontos középpontján. Ennek az az oka, hogy a mágnes egyik végén lévő N pólus hatását a tekercs másik végén pontosan kioltja a mágnes S pólusának hatása a tekercs másik végén
Mekkora a Cao képződésének entalpiája?

A vegyület képződési hőinek táblázata ΔHf (kJ/mol) CaCO3 -1207,0 CaO(s) -635,5 Ca(OH)2(s) -986,6 CaSO4(s) -1432,7
Hogyan hasonlítható össze az elemek bősége a Földön az emberekben lévő elemek bőségével?

Az oxigén a legelterjedtebb elem mind a Földön, mind az emberekben. A szerves vegyületeket alkotó elemek mennyisége az emberben növekszik, míg a metalloidok mennyisége nő a Földön. A Földön bőségesen előforduló elemek elengedhetetlenek az élet fenntartásához
Mi az abszolút nulla és miért nevezik így?

Az abszolút nulla - 273,15 Celsius-fok, -459,67 Fahrenheit-fok és 0 Kelvin. Azért hívják, mert ez az a pont, ahol a természet alapvető részecskéi minimális rezgésmozgással rendelkeznek, csak a kvantummechanikai, nullponti energia által indukált részecskemozgást tartják meg
