
- Szerző Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Utoljára módosítva 2025-01-22 17:00.
Megtalálni a normál idézetet ionizációs energia , ezt az értéket megszorozzuk az a-ban lévő atomok számával anyajegy hidrogénatomok (az Avogadro-állandó), majd elosztjuk 1000-zel az átalakuláshoz joule nak nek kilojoule . Ez jól összevethető a hidrogén normál értékével ionizációs energia 1312-ből kJ mol -1.
Ebből hogyan találja meg a be3+ ionizációs energiáját?
Az ionizációs energia szintén arányos Z^2-vel, mivel ez a különbség az atom/ion alapállapota és a energia az elválasztott ion plusz elektron. A Be^(4+) töltése négyszerese a H^+-nak, tehát a ionizációs energia Be^(3+) értéke 4^2 vagy 16-szorosa H-nek.
Hasonlóképpen, mire használják az ionizációs energiát? Ionizációs energia fontos, mert lehet szokott segít megjósolni a kémiai kötések erősségét. Egységek: Ionizációs energia kilojoule per mol (kJ/mol) vagy elektronvolt (eV) egységekben adják meg.
Ezt követően az is felmerülhet, hogy hogyan számítják ki az ionizációs potenciált?
Ossza el az ionizált tömeget grammban az atomtömegszámmal. Ha például 24 gramm oxigénje van, amelynek atomtömege 16, akkor 1,5 molja van. Szorozzuk meg a ionizálás energia, amit 96,485-tel nézett ki. 1 eV/részecske 96,485 kJ/mol.
Mik az ionizációs energia példái?
Az ionizációs energia egy atom mennyisége energia szükséges egy elektron eltávolításához az adott atom vagy ion gáznemű formájából. 1utca ionizációs energia - Az energia a legmagasabb eltávolításához szükséges energia semleges gáz halmazállapotú atomból származó elektron. Mert Példa : Na(g) → Na+(g) + e- én1 = 496 kJ/mol.
Ajánlott:
Hogyan számítja ki a szórást a PMP-től?

A PMBOK-ban a szórásra használt képlet egyszerű. Ez csak (P-O)/6. Ez a pesszimista aktivitásbecslés mínusz az optimista aktivitásbecslés osztva hattal. A probléma az, hogy ez az alakzat vagy forma semmilyen módon nem eredményez szórást
Mekkora a nitrogén ionizációs energiája kJ mol?

A molekuláris nitrogén ionizációs energiája 1503 kJ mol-1, az atomi nitrogéné 1402 kJ mol-1. A molekuláris nitrogénben lévő elektronok energiája ismét kisebb, mint az elválasztott atomokban lévő elektronok energiája, tehát a molekula kötött
Hogyan számítja ki a forgási kinetikus energiát?
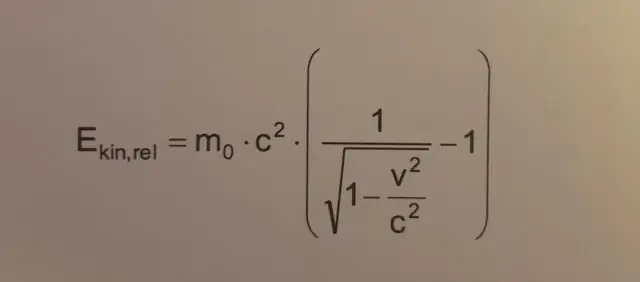
A forgási kinetikus energia a következőképpen fejezhető ki: Erotációs=12Iω2 E forgási = 1 2 I ω 2 ahol ω a szögsebesség, I pedig a forgástengely körüli tehetetlenségi nyomaték. A forgás során alkalmazott mechanikai munka a forgatónyomaték szorzata a forgásszöggel: W=τθ W = τ θ
Hogyan befolyásolja a coulombos vonzás az ionizációs energiát?

Minél nagyobb az ionizációs energia, annál nehezebb az elektron eltávolítása. Ugyanezen coulombikus vonzási elképzelések segítségével megmagyarázhatjuk a periódusos rendszer első ionizációs energiatrendjeit. Minél nagyobb egy atom elektronegativitása, annál nagyobb a képessége, hogy magához vonzza az elektronokat
Hogyan kapcsolódik a Coulomb-törvény az ionizációs energiához?

Az atom ionizációs energiája az atomban kötött elektron és az atomtól végtelen távolságra lévő elektron közötti energiakülönbség. A Coulomb-törvény megadja az elektromos potenciálenergiát két ponttöltés között, a köztük lévő r távolsággal. Az energia fordítottan arányos ezzel a távolsággal
