
- Szerző Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Utoljára módosítva 2025-01-22 17:00.
Van der Waals erők” általános kifejezés meghatározni a molekulák közötti intermolekuláris erők vonzása. Kétféle van Van der Waals erők: gyenge London Dispersion Forces és erősebb dipólus-dipólus erők.
Akkor mi a példa a van der Waals-erőre?
Van der Waals erők a gyengék erők amelyek hozzájárulnak a molekulák közötti intermolekuláris kötésekhez. Példák nak,-nek van der Waals erők hidrogénkötés, diszperzió erők és dipól-dipól kölcsönhatások.
Másodszor, hogyan számítják ki a van der Waals erőket? Van der Waals egyenlet A V a képlet a gáz térfogatára vonatkozik, mólban n. Az intermolekuláris erők vonzásának beépülnek a egyenlet az n 2 a V 2 frac{n^2a}{V^2} V2n2a-val? kifejezés ahol a a a egy adott gáz meghatározott értéke.
Hasonlóképpen, mi okozza a van der Waals erőket?
Meghatározás. Van der Waals erők ide tartozik az atomok, molekulák és felületek közötti vonzás és taszítás, valamint egyéb intermolekuláris erők . Abban különböznek a kovalens és ionos kötéstől, hogy azok okozta a közeli részecskék ingadozó polarizációinak korrelációival (a kvantumdinamika következménye).
Miért olyan gyenge van der Waals?
Van der Waals erők más néven London Dispersion Erők vannak gyenge mivel ezek okozzák az atomok átmeneti dipólusmozgását. Nemesgázokban figyelemre méltó.
Ajánlott:
Mit jelent a van't Hoff faktor?
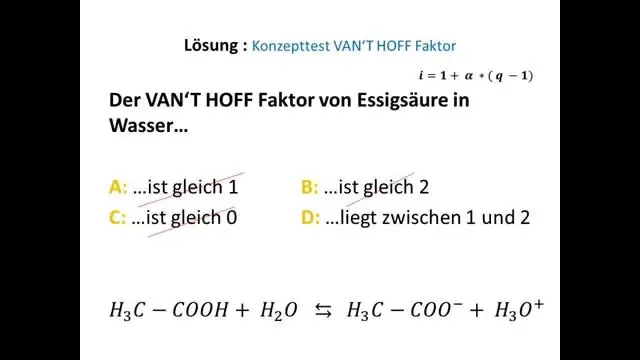
Wiki- A van 't Hoff-tényező az anyag feloldásakor keletkező részecskék tényleges koncentrációja és az anyag tömegéből számított koncentrációja közötti arány. A vízben oldott legtöbb nem elektrolit esetében a van't Hoff-tényező lényegében 1
Hogyan jön létre a van der Waals interakció?

Van der Waals interakciók. A van der Waals kölcsönhatások akkor lépnek fel, amikor a szomszédos atomok olyan közel kerülnek egymáshoz, hogy külső elektronfelhőik alig érintkeznek. Ez a művelet töltésingadozást indukál, ami nem specifikus, nem irányult vonzást eredményez. Ha két atom túl közel kerül egymáshoz, erősen taszítják egymást
Hol működnek a Van der Waals erők?

Meghatározás. A Van der Waals erők közé tartoznak az atomok, molekulák és felületek közötti vonzás és taszítás, valamint más intermolekuláris erők. Abban különböznek a kovalens és ionos kötéstől, hogy a közeli részecskék ingadozó polarizációinak korrelációi okozzák őket (a kvantumdinamika következménye)
Melyik kötés erősebb a hidrogén vagy a van der Waals?

A hidrogénkötések jellemzően erősebbek, mint a Van der Waals erők. Ezek a kötések hosszú távúak és meglehetősen erősek. A Van der Waals erők ideiglenes dipólusokon alapulnak, amelyek akkor képződnek, amikor a molekulák áramlási vagy mozgási állapotban vannak
Mit jelent és mit jelent a hossz?

Válasz és magyarázat: Amikor mérésekkel dolgozik, az egy idézőjel(') lábat, a kettős idézőjel ('') pedig hüvelyket jelent
