
Tartalomjegyzék:
- Szerző Miles Stephen [email protected].
- Public 2024-01-18 08:16.
- Utoljára módosítva 2025-06-01 05:04.
Ideális gáztörvény képlete
- Ideális gáztörvény A képletekkel kapcsolatos kérdések:
- Válasz: A térfogat V = 890,0 ml, a hőmérséklet T = 21 °C, a nyomás pedig P = 750 Hgmm.
- PV = nRT.
- Válasz: A mólok száma n = 3,00 mol, a hőmérséklet T = 24°C és a nyomás P = 762,4 Hgmm.
- PV = nRT.
Ezen kívül hogyan számítja ki az ideális gáztörvényt?
Az ideális gáz tulajdonságait egy pV = nRT formájú képlet tartalmazza, ahol:
- p a gáz nyomása Pa-ban mérve,
- V a gáz térfogata, m^3-ben mérve,
- n az anyag mennyisége mólokban mérve,
- R az ideális gázállandó és.
- T a gáz hőmérséklete Kelvinben mérve.
Hasonlóképpen, miért fontos az ideális gáz törvénye? Boyle-é Törvény kimondja, hogy ha a hőmérséklet állandó, akkor egy rögzített minta nyomása és térfogata a gáz fordítottan arányosak (P1 x V1 = P2 x V2). A jelentősége tehát az, hogy a ideális gáztörvény kiszámítja bármelyik viselkedését gáz általános hőmérsékleti és nyomási feltételek mellett.
Az is kérdés, hogy hogyan találja meg a nyomást az ideális gáztörvény segítségével?
Először tekintsük át a ideális gáztörvény PV = nRT. Ebben az egyenletben 'P' a nyomás atmoszférában a „V” a térfogat literben, az „n” a részecskék száma mólokban, a „T” a hőmérséklet Kelvinben és az „R” a ideális gáz állandó (0,0821 liter atmoszféra per mol Kelvin).
Melyek az ideális gáztörvény mértékegységei?
SI-mértékegységben p mértékegysége pascal , V-t köbméterben, n-t mólban, T-t pedig in-ben mérnek kelvineket (az Kelvin skála egy eltolt Celsius skála, ahol 0,00 K = -273,15 °C, a lehető legalacsonyabb hőmérséklet). R értéke 8,314 J/(K. mol) ≈ 2 cal/(K.
Ajánlott:
Hogyan oldja meg a Hardy Weinberg-problémákat?

VIDEÓ Ezen kívül hogyan találja meg P-t és Q-t Hardy Weinbergben? Mivel p = 1 - q és q ismert, lehetséges kiszámítja p is. Tudva p és q , egyszerű dolog ezeket az értékeket a Hardy - Weinberg egyenlet (p² + 2pq + q² = 1). Ez megadja a populáción belül a kiválasztott tulajdonság mindhárom genotípusának előrejelzett gyakoriságát.
Hogyan oldja meg a törtek szorzását és osztását?
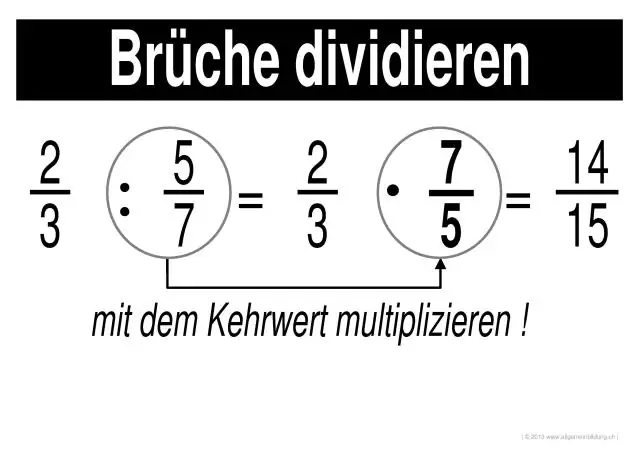
Törtek szorzása és osztása 1. lépés: Szorozzuk meg az egyes törtek számlálóit egymással (a felül lévő számokkal). Az eredmény a válasz számlálója. 2. lépés: Szorozzuk meg az egyes törtek nevezőit egymással (az alsó számok). Az eredmény a válasz nevezője. 3. lépés: Egyszerűsítse vagy csökkentse a választ
Hogyan oldja meg az identitástulajdonságot?

Az identitástulajdonság két részből áll: Additív identitás és Multiplikatív identitás. Adjunk hozzá nullát (0) egy számhoz, az összeg ez a szám. Szorozzuk meg a számot 1-gyel, a termék ez a szám. Ossz el egy számot önmagával, a hányados 1
Hogyan oldja meg grafikusan az LP-t Excelben?
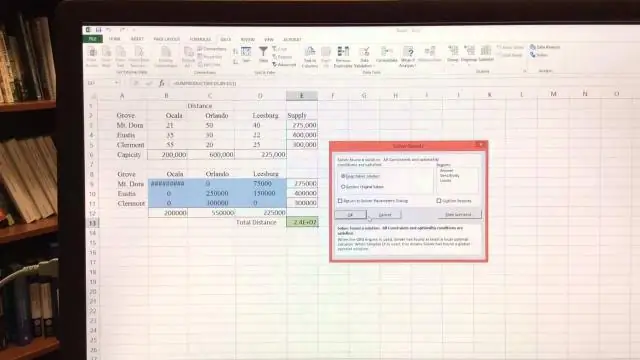
VIDEÓ Ilyen módon hogyan lehet grafikusan megoldani egy problémát? Nak nek megoldani egy egyenlet azt jelenti, hogy megtaláljuk az összes értéket, amely igazzá teszi az állítást. Nak nek megoldani egy egyenlet grafikusan , rajzolja meg a grafikont az egyenlet minden oldalára, tagjára, és nézze meg, hogy a görbék hol egyenlők.
Hogyan oldja meg a centripetális gyorsulást?

A centripetális („középpont-kereső”) gyorsulás a kör középpontja felé irányuló befelé irányuló mozgás. A gyorsulás egyenlő a sebesség négyzetével, osztva a körpálya sugarával
