
- Szerző Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Utoljára módosítva 2025-01-22 17:00.
H2SO4 moláris tömege a megfelelő összeadásával számítható ki moláris tömegek az azt alkotó összes elem közül. Moláris tömege H(x2)+ Moláris tömege Kén(x1)+ Moláris tömege Oxigén (x4). =>98 g/mol.
Azt is megkérdezték, mi a h2so4 molekulatömege?
98,079 g/mol
Hasonlóképpen, hogyan számíthatom ki a molekulatömeget? Kiszámítja az egyes elemek össztömege molekula . Szorozzuk meg az egyes elemek atomtömegét az adott elem atomjainak számával: (az elem atomtömege) x (az elem atomjainak száma). Tegye ezt az egyes elemekkel a molekula . A szén-dioxid példában ennek az egyetlen szénatomnak a tömege 12,011 amu.
Illetve hogyan találja meg a h2so4 egyenértékű tömegét?
Egyenértékű súlyok a moláris tömegekből számítható, ha az anyag kémiája jól ismert: kénsav őrlőfoga van tömeg 98,078(5)gmol−1, és két mol hidrogéniont szolgáltat egy mólban kénsav , tehát ez egyenértékű súly 98,078(5)gmol−1/2 ekv mol−1 = 49,039(3)g ekv −1.
Mennyi az oxigén tömegszázaléka a h2so4-ben?
Százalékos összetétel elemenként
| Elem | Szimbólum | Tömegszázalék |
|---|---|---|
| Hidrogén | H | 2.055% |
| Oxigén | O | 65.251% |
| Kén | S | 32.693% |
Ajánlott:
Hogyan találja meg a NaOH molekulatömegét?

Válasz és magyarázat: A nátrium-hidroxid moláris tömege 39,997 g/mol. A moláris tömeg meghatározásához szorozzuk meg az atomtömeget a képletben lévő atomok számával
Hogyan találja meg az átlagos sebességet két sebességgel?
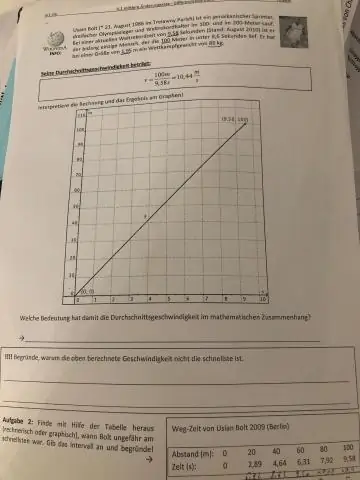
A kezdeti és a végsebesség összegét elosztjuk 2-vel, hogy megkapjuk az átlagot. Az átlagsebesség-kalkulátor azt a képletet használja, amely azt mutatja, hogy az átlagsebesség (v) egyenlő a végső sebesség (v) és a kezdeti sebesség (u) összegével, osztva 2-vel
Hogyan találja meg a folyékony keverék fajsúlyát?

Most ossza el a teljes sűrűséget a víz sűrűségével, és megkapja a keverék SG-jét. Melyik a legnagyobb sűrűségű folyadék? Ha egyenlő térfogatú két anyagot keverünk össze, a keverék fajsúlya 4. Egy p sűrűségű folyadék tömege keveredik egy másik, 3p sűrűségű folyadék azonos tömegével
Hogyan találja meg a h2so4 egyenértékű tömegét?

Az ekvivalens tömegek a moláris tömegekből számíthatók, ha az anyag kémiai összetétele jól ismert: a kénsav móltömege 98,078(5)gmol&mínus 1/2eqmol−1 = 49,039(3)geq−1
Hogyan befolyásolja a fagyáspont-depresszió a molekulatömeget?

Így a moláris tömeg növekedésével a fagyáspont-depresszió csökken. Vagyis a moláris (vagy molekula) tömeg növelése kisebb hatással lesz a fagyáspontra
